TABLA PERIÓDICA DE LOS ELEMENTOS
Antecedentes
históricos
La historia
de la tabla periódica es fascinante y se remonta a mediados del siglo XIX. Aquí
tienes un resumen de los eventos más importantes:
Antoine Lavoisier (1789): Publicó una lista de 33 elementos químicos, agrupándolos en gases, metales, no metales y tierras.
Johann Wolfgang Döbereiner (1817): Identificó grupos de tres elementos con propiedades similares, conocidos como "tríadas".
Leopold Gmelin (1843): Identificó diez tríadas y otros grupos de elementos.
André-Émile Béguyer de Chancourtois (1862): Creó la "hélice
telúrica", una representación espiral de los elementos ordenados por peso
atómico.
Julius Lothar Meyer (1864): Publicó una versión temprana de la tabla periódica basada
en el peso atómico.
Dmitri Mendeléyev (1869): Publicó la primera versión de la tabla periódica moderna,
organizando los elementos por peso atómico y prediciendo la existencia de
elementos aún no descubiertos.
Alfred Werner (1905): Desarrolló la estructura actual de la tabla periódica basada en la
estructura electrónica de los elementos.
Gil Chaverri (1921): Presentó una versión de la tabla periódica considerando la estructura
electrónica en lugar del número de protones.
La tabla
periódica ha evolucionado significativamente desde entonces, pero sigue siendo
una herramienta fundamental en la química.
¿Cómo se
estructura la tabla periódica?
La tabla
periódica se estructura de manera que los elementos químicos están organizados
según sus propiedades químicas y físicas. Aquí tienes una explicación detallada
de su estructura:
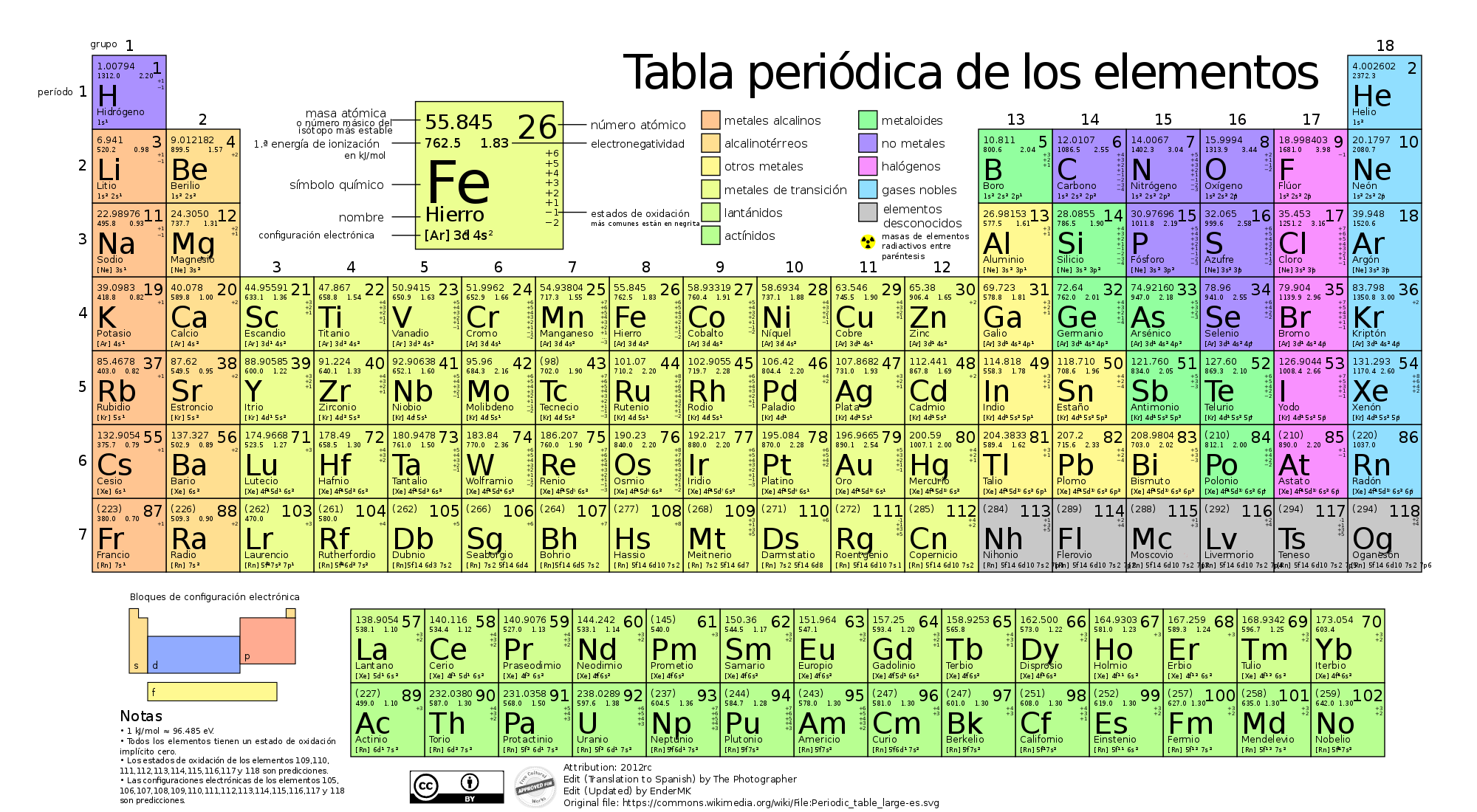
1.Filas (Periodos): La tabla está dividida en filas horizontales llamadas periodos. Hay
siete periodos en total, y cada uno representa el nivel de energía principal
que ocupan los electrones de los átomos de los elementos en ese periodo.
2.Columnas (Grupos o Familias): Las columnas verticales se llaman grupos o familias. Hay 18
grupos en la tabla periódica moderna. Los elementos en el mismo grupo tienen
propiedades químicas similares porque tienen la misma cantidad de electrones en
su capa de valencia (la capa más externa de electrones).
3.Metales, No Metales y Metaloides: Los elementos se dividen en tres categorías principales:
- Metales: Ubicados a la izquierda y en el centro de la tabla. Son buenos conductores de calor y electricidad, y suelen ser maleables y dúctiles.
- No Metales: Ubicados a la derecha de la tabla. Son malos conductores de calor y electricidad y tienen propiedades muy variadas.
- Metaloides: Se encuentran en una diagonal entre los metales y no metales. Tienen propiedades intermedias entre ambos.
4.Bloques: La
tabla periódica se puede dividir en bloques basados en el subnivel electrónico
que se está llenando:
- Bloque s: Incluye los grupos 1 y 2 y el
hidrógeno y helio.
- Bloque p: Incluye los grupos 13 al 18.
- Bloque d: Incluye los metales de transición,
que son los grupos 3 al 12.
- Bloque f: Incluye los lantánidos y actínidos,
que suelen mostrarse como filas separadas en la parte inferior de la tabla.
5.Elementos Representativos y de Transición:
- Elementos representativos (grupos 1,
2 y 13-18): Tienen
propiedades más predecibles y varían gradualmente en un grupo.
- Metales de transición (grupos 3-12): Tienen propiedades menos
predecibles y pueden formar compuestos con diferentes estados de oxidación.

Buena información, bien explicada
ResponderEliminarExcelente información profe
ResponderEliminarmuy buena información
ResponderEliminarExcelente afirmación,muy bien explicadas y fácil de aprender
ResponderEliminarGracias por compartir este tema
ResponderEliminarMuy interesante 🤗👍
Gracias por compartir
ResponderEliminar